Naukowcy z University of Washington przeprojektowali proteinę, która pobudza układ odpornościowy do walki z nowotworami. Dzięki temu wyeliminowali niebezpieczne skutki uboczne, które pojawiały się podczas stosowania białka. W testach na myszach nowy związek silnie hamował wzrost nowotworów, a u części zwierząt doprowadził nawet do usunięcia guzów.
Dla pacjentów z agresywnym nowotworem nerki czy skóry proteina pobudzająca układ immunologiczny do walki - interleukina-2 (IL-2) może być jedynym ratunkiem. Jednak dawki, przy których jest najbardziej skuteczna, mają skutki uboczne na tyle poważne, że mogą stwarzać zagrożenie dla życia pacjenta.
Naukowcy dzięki modelowaniu komputerowemu zaprojektowali to białko jeszcze raz od podstaw. Nowa proteina naśladuje zdolności IL-2 do pobudzania odpowiedzi układu odpornościowego, ale nie ma przy tym niebezpiecznych skutków ubocznych. Białko to do tej pory było testowane tylko na zwierzętach, ale wkrótce mogą ruszyć testy kliniczne także na ludziach.
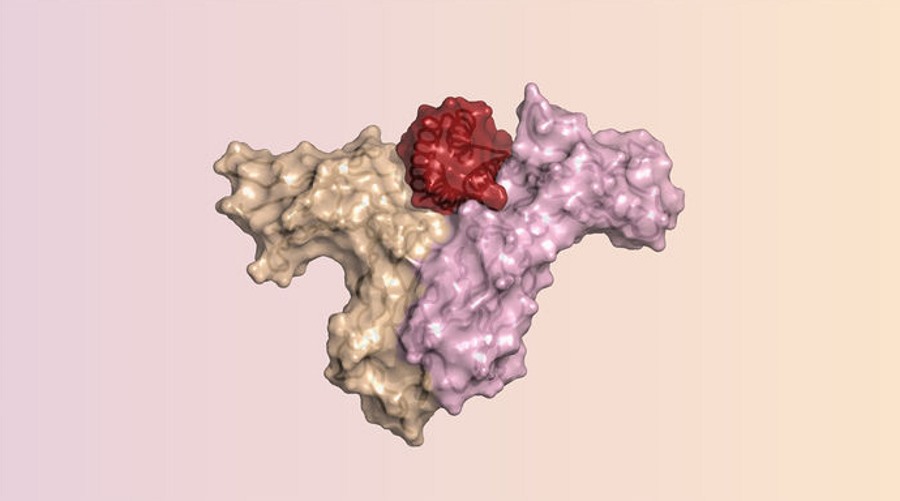
Interleukina-2 odgrywa kluczową rolę w kierowaniu odpowiedzi immunologicznej organizmu na intruza. To cytokina. Zwiększa aktywność limfocytów T poprzez wiązanie się jednocześnie z ich receptorami IL-2β i IL-2γ. W komórkach, w których występuje trzeci typ receptora - IL-2α, wiąże się kolektywnie ze wszystkimi trzema, jednak to ostatnie wiązanie, w komórkach budujących naczynia krwionośne, może spowodować ich przeciekanie – stan zagrażający życiu.
- Przez 30 lat ludzie próbowali zmienić IL-2, aby uczynić proteinę bezpieczniejszą i bardziej skuteczną - powiedział Daniel Adriano Silva Manzano, biochemik z University of Washington w Seattle (UW) i główny autor badań. Ale IL-2 jest niestabilna i przestaje działać, kiedy traci swój normalny kształt, a wiele mutacji jeszcze bardziej destabilizuje jej strukturę.
Do zaprojektowania IL-2 od nowa badacze z UW połączyli siły z kolegami z Portugalii, Hiszpanii i Wielkiej Brytanii. Prace rozpoczęto od analizy sposobów wiązania się proteiny z receptorami β i γ, a także z receptorem α. IL-2 to pojedynczy długi łańcuch aminokwasów. Kiedy składa się w aktywny kształt 3D, tworzy cztery segmenty, które skręcają się w spirale zwane helisami alfa. W strukturze helis znajdują się dwa miejsca, które wiążą się z receptorami β i γ. Z receptorami α łączą się natomiast części jednej z helis i dwa inne miejsca w spirali.
Badacze skorzystali z oprogramowania stworzonego przez Davida Bakera, projektanta białek z UW. Program nazwany Rosetta służy właśnie do projektowania białek. Dzięki temu naukowcy w nowym białku utrzymali potrzebne interakcje z receptorami β i γ, ale wyeliminowali część, która wiąże się z receptorami α. Program Rosetta zaproponował 40 opcji. Po ich przeanalizowaniu zespół zsyntetyzował i przetestował 22 z nich.
Ostatecznie naukowcy ustalili wersję, którą nazwali Neo-2/15. Dzieli ona tylko 14 proc. swojej sekwencji aminokwasów z IL-2. Badania laboratoryjne wykazały, że Neo-2/15 wiąże się z receptorami β i γ, ale nie z receptorami α. W mysich modelach raka jelita grubego i czerniaka, związek zmniejszał działania uboczne związane z receptorami α, silnie hamował wzrost nowotworu, a u części zwierząt nawet eliminował nowotwory.
Wyniki prac zespołu ukazały się na łamach pisma „Nature”.
- To genialne opracowanie – powiedział James Olson, onkolog w Fred Hutchinson Cancer Research Center w Seattle, który nie był zaangażowany w badania. Olson dodał, że jeśli w testach na ludziach Neo-2/15 ograniczy niebezpieczne skutki uboczne, lekarze zyskają nowy środek, który może zapewnić pacjentom dłuższy czas leczenia, co pomoże układowi odpornościowemu usunąć nowotwór.
Powiązana z UW firma Neoleukin Therapeutics pracuje obecnie nad wprowadzeniem Neo-2/15 do testów klinicznych. Naukowcy z firmy badają, w jaki sposób przeciwciała mogą kierować się na białko w nowotworach, a nie w zdrowych komórkach, tak aby nie wywołać reakcji autoimmunologicznej,.
Baker przyznał, że podobne podejście do selektywnego poszukiwania określonych receptorów, może okazać się użyteczne w zwiększaniu odpowiedzi immunologicznej przeciwko innym typom nowotworów, a także w tłumieniu odpowiedzi immunologicznej na choroby autoimmunologiczne.
Źródło: Science, fot. Ian Haydn/ Institute for Protein Desing