Mikroskopia krioelektronowa umożliwiła obserwację białek w niespotykanym dotąd stopniu szczegółowości. Dopracowana niedawno technika obrazowania cząsteczek ukazała badaczom pojedyncze atomy w białku. – To zmienia reguły gry w nauce, otwiera przed nami zupełnie nowy wszechświat – przekonują badacze.
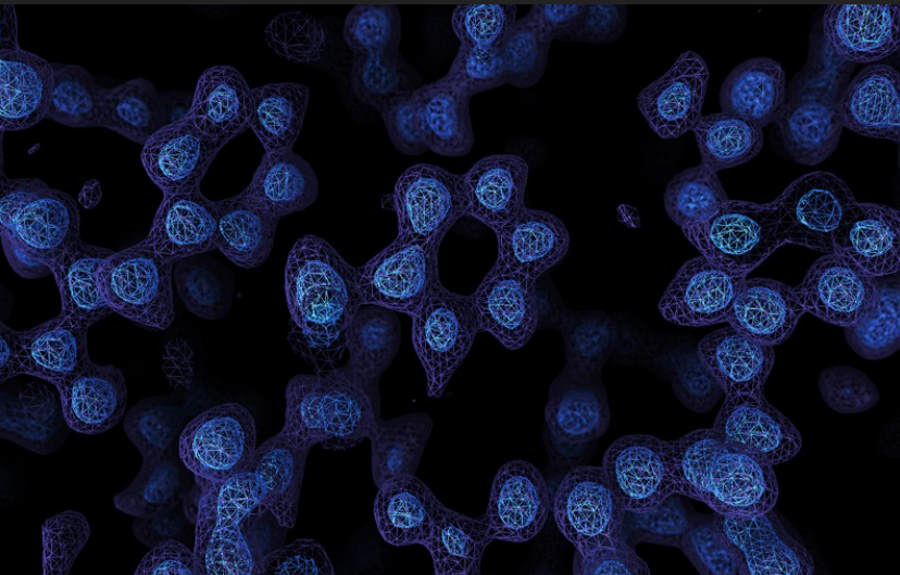
Mikroskopia krioelektronowa (z j. ang. Electron cryomicroskopy, CryoEM) jest techniką mikroskopową, umożliwiającą obserwowanie atomów znajdujących się w białkach. Za udoskonalenie metody Jacques Dubochet, Joachim Frank i Richard Henderson otrzymali w 2017 roku nagrodę Nobla.
W technologii CryoEM wykorzystuje się soczewki (będące cewkami elektrycznymi) i obiektywy, jednak zamiast wiązki światła, przepuszcza się przez nie wiązkę elektronów. Obserwacje wykonuje się w próżni i mogą one przybliżyć obraz nawet 3000000 razy. Dla porównania najdokładniejszy mikroskop daje powiększenie rzędu 2000 razy.
CryoEM może pomóc naukowcom w zrozumieniu tego, w jaki sposób działają białka, także pozostające w ruchu. Do tej pory żadna inna znana technika, jak np. krystalografia rentgenowska, nie oferowała takich możliwości.
Przełomowe badania z wykorzystaniem CryoEM ogłosiły niedawno dwa laboratoria. Dzięki wykorzystaniu technologii uzyskano trójwymiarowe obraz białek. Lepsze poznanie ich struktur może pomóc w opracowaniu nowych, skuteczniejszych i mniej szkodliwych leków.
- To kamień milowy. Naprawdę nie ma już nic więcej do odkrycia. Pokonaliśmy ostatnią barierę - mówi Holger Stark, biochemik pracujący przy najnowocześniejszych mikroskopach w Instytucie Maxa Plancka w Getyndze. Naukowiec prowadził jedno z przełomowych doświadczeń. Drugie badanie wykonali Sjors Scheres i Radu Aricescu, biolodzy z Medical Research Council Laboratory of Molecular Biology (MRC-LMB) w Cambridge w Wielkiej Brytanii. Wyniki obu badań zamieszczono w bazie pre-printów bioRxiv (1, 2).
Wyniki badań wzbudziły w środowisku naukowym wielki entuzjazm. Naukowcy zdają sobie sprawę, że poznanie struktur atomowych wszystkich białek może zająć jeszcze wiele lat, ale pierwsze rezultaty napawają optymizmem.
Badania nad technologią CryoEM trwają od kilkudziesięciu lat. Prawdziwy przełom nastąpił w 2013 roku, zaczęto mówić nawet o "rewolucji rozdzielczości”. Naukowcy mogli wtedy obserwować białka w wysokiej ostrości i ogromnym powiększeniu. Wciąż jednak najdokładniejszą techniką pozostawała krystalografia rentgenowska, która odtwarza struktury białek ze wzorów dyfrakcyjnych tworzonych przez kryształy białkowe podczas bombardowania ich promieniami rentgenowskimi.
Z czasem postęp technologiczny doprowadził do poprawy rozdzielczości obrazowania za pomocą CryoEM. Zaletą tej techniki jest możliwość obserwacji „działania” białek oraz brak konieczności wcześniejszego, długotrwałego przygotowywania materiału badawczego. W przypadku CryoEM wystarczy, aby białko znajdowało się w oczyszczonym roztworze.
Mapy białkowe uzyskane za pomocą nowej techniki są tak precyzyjne, że wskazują na położenie poszczególnych atomów w białku, w rozdzielczości około 1,2 angstrema (ok. 1,2 × 10-10 m). Odkryte struktury mogą się okazać niezwykle przydatne dla zrozumienia działania enzymów i późniejszej możliwości identyfikacji leków, które będą blokowały lub zwiększały ich aktywność.
Oba zespoły, które opublikowały niedawno wyniki swoich badań, pracowały nad stabilnym białkiem przechowującym żelazo nazywanym apoferrytyną. Wcześniej można było zaobserwować je w rozdzielczości 1,54 angstrema. Celem było poprawienie tego wyniku i uzyskanie ostrzejszych zdjęć białka. Badacze zastosowali najnowsze techniki: regulujące szybkość przepływu elektronów, redukujące szum zakłócający obraz, czy czulsze kamery wykrywające elektrony. Uzyskano dzięki temu obraz o rozdzielczości 1,2 angstrema. Był on tak dokładny, że naukowcy mogli obserwować pojedyncze atomy wodoru w białku jak i otaczających je cząsteczkach wody.
Badacze planują kontynuację swoich eksperymentów i zamierzają połączyć siły, aby uzyskać obraz w rozdzielczości 1 angstrema. Jeszcze większe powiększenie wydaje się niemożliwe i wymagałoby wielu lat samej tylko rejestracji danych.
W swoich wcześniejszych badaniach Sjors Scheres i Radu Aricescu analizowali wygląd innego białka – receptora GABAA, które znajduje się w neuronach. Najpierw dzięki CryoEM uzyskali obraz o rozdzielczości 2,5 angstrema. Po udoskonaleniu urządzeń rozdzielczość poprawiła się do 1,7 angstrema. - To było jak coraz ostrzejsze widzenie, wyostrzanie rozmytego obrazu - mówi Aricescu. – Przy takich rozdzielczościach każda połowa angstrema otwiera cały wszechświat – dodaje.
Badania ujawniły nieznane szczegóły w białkach, jak na przykład cząsteczki wody w kieszeni, w której znajduje się histamina. - To jest kopalnia złota, dzięki której będziemy mogli projektować leki oparte na tej strukturze - ocenia Aricescu.
Wyzwaniem dla badaczy pozostanie „ustabilizowanie” białek, które nie są aż tak trwałe jak apoferrytyna. Naukowcy już mają jednak plan, który ma polegać na zamrażaniu białek w mikrostrukturach wykonanych ze złota.
- Wszyscy są bardzo podekscytowani naprawdę zdumiewającym poziomem wydajności zademonstrowanym przez obie grupy badaczy - mówi Radostin Danev, specjalista CryoEM na Uniwersytecie Tokijskim. Zgadza się on również, że kolejnym wyzwaniem będzie konieczność ustabilizowania próbek białek.
Wyniki badań opisuje na swoich stronach „Nature”