W środę Królewska Szwedzka Akademia Nauk ogłosiła, że tegoroczną Nagrodę Nobla w dziedzinie chemii otrzymają: Jacques Dubochet, Joachim Frank i Richard Henderson. Uhonorowano ich za prace nad metodą mikroskopii krioelektronowej, która pozwala obrazować duże cząsteczki biologiczne w rozdzielczości niemal atomowej.
- Choć Noble czasem są kontrowersyjne - to akurat ta nagroda jest w pełni zasłużona - oceniła w rozmowie z PAP prof. Marta Dziedzicka-Wasylewska z Zakładu Biochemii Fizycznej Uniwersytetu Jagiellońskiego.
Jej zdaniem tegoroczny chemiczny Nobel bardzo dobrze obrazuje sposób, w jaki rozwija się współczesna nauka. - Nagrodę z chemii dostali w zasadzie biofizycy z mniejszym lub większym zacięciem w kierunku biologii molekularnej. Przy czym ta technologia ma tak naprawdę kolosalne znaczenie dla biologii i biochemii - to wszystko jest więc interdyscyplinarne - dodała.
Jak wyjaśniła, mikroskopia krioelektronowa ma kolosalne znaczenie, ponieważ znajomość dokładnej struktury molekuł, takich jak np. białek czy kwasów nukleinowych, pozwala modelować różne związki, które potem mogą wchodzić z tymi molekułami w interakcję.
Oznacza to, że jeśli dogłębnie znamy strukturę określonego białka, to możemy je np. hamować - mechanizm ten często stosowany jest w różnych lekach. - Jeśli znamy strukturę np. rybosomu, możemy projektować związki, które będą nowymi antybiotykami. Jest to szalenie ważne w obecnej dobie, kiedy tak naprawdę w tym obszarze badań nie było do niedawna dużego postępu - podkreśliła naukowiec z UJ.
Struktury podobne do rybosomu - czyli struktury w komórce odpowiadającej za syntezę białek - znaleźć możemy również u bakterii. - Hamując funkcjonowanie tych struktur, możemy walczyć z różnymi infekcjami bakteryjnymi - tłumaczyła prof. Dziedzicka-Wasylewska. - Ale żeby zrobić to prawidłowo, musimy bardzo dobrze poznać strukturę, którą chcemy hamować. A dzięki mikroskopii krioelektronowej możemy to białko czy kompleks białkowy zobaczyć na poziomie atomowym.
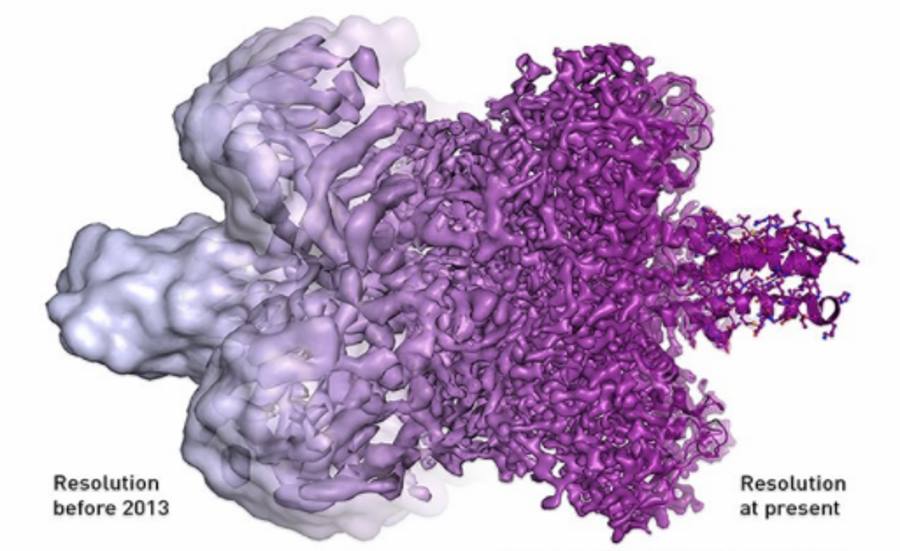
Mikroskopia krioelektronowa jest nowością w nauce - pożądaną przez naukowców rozdzielczość atomową udało się uzyskać dopiero w 2013 r. - Odkrycia czasem czekają na uznanie Komitetu Noblowskiego nawet 20 czy 30 lat - zauważyła prof. Dziedzicka-Wasylewska. - Tymczasem, pomimo tego, że potrzebny sprzęt jest bardzo drogi i skomplikowany, to od tego 2013 r. udało już się bardzo wiele tych nowych struktur pokazać. Mamy np. przepiękne prace pokazujące jak tzw. fagi, czyli wirusy atakujące bakterie, łączą się ze ścianą komórki bakteryjnej, jak materiał genetyczny faga wnika potem do tej bakterii - to są fenomenalne zdjęcia.
Dodała, że już wcześniej naukowcy dysponowali różnymi metodami, dzięki którym można zobaczyć w rozdzielczości atomowej strukturę np. białka, ale musieli do tego używać kryształów białka. - Choć więc krystalografia oddała wielkie zasługi, to ogromną zaletą mikroskopii krioelektronowej jest to, że nie potrzebujemy "zamrożonego" kryształu tej molekuły, którą chcemy badać. Obserwowana cząsteczka nie jest już więc sztywna, zamknięta w krysztale - podkreśliła.
Według badaczki w Polsce nie ma mikroskopów krioelektronowych, najbliższy sprzęt tego typu znajduje się w Niemczech. - Kosztuje on ponad 30 mln zł i wymaga specjalnych pomieszczeń - opisała prof. Dziedzicka-Wasylewska, dodając, że z uwagi na tak wysokie kwoty, starania o tę technologię w Polsce powinny być prowadzone na poziomie rządowym. - Żadna pojedyncza jednostka naukowa nie jest w stanie zapewnić sobie funduszy na takim poziomie, ale rzeczywiście jest to gra warta świeczki - dodała.
"Następnym krokiem będzie oglądanie cząsteczek w akcji"
- Już teraz mikroskopia krioelektronowa, której twórcy dostali w tym roku Nobla z chemii, jest wykorzystywana do opracowywania leków. Ale następnym krokiem będzie oglądanie cząsteczek "w akcji - ocenił z kolei prof. Adam Liwo z Zakład Modelowania Molekularnego Uniwersytetu Gdańskiego.
- To jest technika, która służy poznaniu struktury cząsteczek biologicznych, zwłaszcza biomakromolekuł, czy nawet układów w środowisku naturalnym - powiedział w rozmowie z PAP prof. Liwo. Naukowiec przyznał, że tegoroczny Nobel z dziedziny chemii nie był dla niego zaskoczeniem. Zdaniem badacza następnym krokiem będzie oglądanie cząsteczek "w akcji" - filmu, a nie statycznych zdjęć.
Prof. Liwo podkreślił, że mikroskopia krioelektronowa jest nie do zastąpienia w badaniach białek błonowych.
- Białka błonowe to te, które odpowiadają np. za 90 proc. przekazywania sygnałów oraz są celami terapii dlatego, że jakikolwiek lek, jakakolwiek cząsteczka się tam przyczepia - to ona musi przejść przez te białka błonowe - wyjaśnił naukowiec.
Przyznał, że metoda spowodowała postęp w nauce. - Raczej bym powiedział, że trzeba patrzeć w przyszłość. Bo jeżeli jesteśmy w stanie właśnie obejrzeć, jak wygląda upakowanie takich cząsteczek białka w błonie komórkowej, no to oczywiście jesteśmy w stanie zaprojektować nowe leki przeciwnowotworowe - wskazał.
Naukowiec zastrzegł, że od uzyskania obrazu w laboratorium do momentu, kiedy zdjęcie ukazuje się np. w gazecie jako wiadomość dnia, jest jeszcze sporo pracy, m.in. w postaci przetworzenia za pomocą programów komputerowych.
Źródło: PAP – Nauka w Polsce, fot. Twitter/Nobelprize